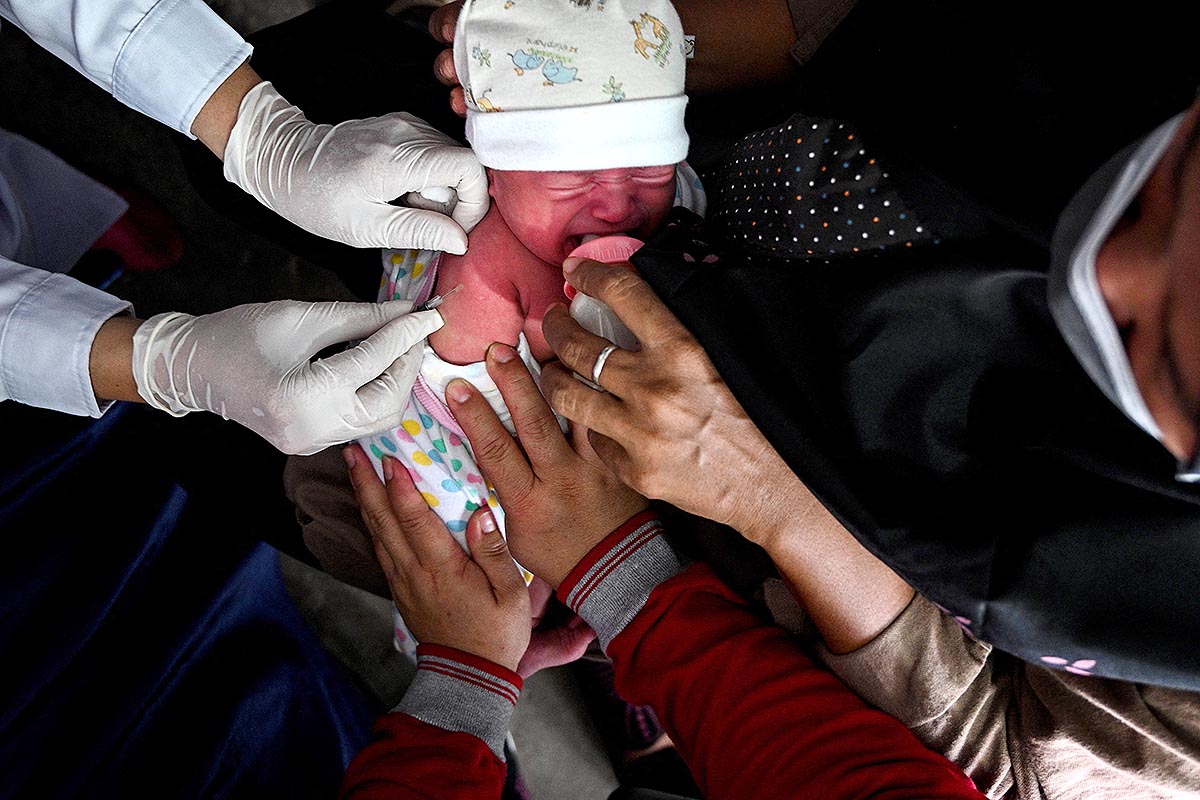
La Administración de Drogas y Alimentos de Estados Unidos (FDA) autorizó este viernes el uso de emergencia de las vacunas contra el coronavirus de Moderna y Pfizer-BioNTech para población pediátrica desde los seis meses de edad, según informó el organismo. Hasta ahora, en ese país, sólo se aplicaba la vacunación a partir de los cinco años.
Para la vacuna de Moderna, que se dará en dos dosis, la FDA modificó la autorización de uso de emergencia (EUA) para incluir su inoculación en personas de 6 meses a 17 años de edad. La vacuna de Pfizer-BioNTech se dará en tres dosis y recibió la autorización para incluir en el uso de emergencia a personas de 6 meses a 4 años.
«La agencia determinó que los beneficios conocidos y potenciales de las vacunas Moderna y Pfizer-BioNTech Covid-19 superan los riesgos conocidos y potenciales en las poblaciones pediátricas autorizadas para el uso de cada vacuna», señaló la FDA en un comunicado, según consignó la agencia Télam.
Cuando comenzó ese proceso de aprobación, días atrás, el Colectivo de Infancias En Riesgo inició las presentaciones al Ministerio de Salud y a Presidencia para que la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) y la Comisión Nacional de Inmunizaciones (CoNaIn) evalúen la información sobre esas vacunas.
“Todes les niñes en nuestro Colectivo han sido contagiados en esta última ola, tal y como advertimos que podía suceder, salvo dos. Han sufrido internaciones en UTI, neumonías bilaterales… Y son contagios sin vacunas. No se sabe qué efecto habrá a largo plazo”, advirtió Sofia Gastellu, referente de ese colectivo y mamá de una beba de dos años que nació prematura y presenta factores de riesgo ante el Covid por un cuadro de displasia broncopulmonal. Su hija y otro bebé con factores de riesgo que pudieron evitar el contagio permanecieron completamente aislados desde el inicio de la pandemia.
Gastellu lleva largo tiempo reclamando medidas para este grupo poblacional, con factores de riesgo y sin vacuna posible aún por tener menos de tres años (edad a partir de la cual se aplica la vacuna Sinopharm en Argentina). Otras familias se unieron en el camino y sumaron más de 800 firmas de apoyo a este pedido. En los Estados Unidos, previo a la aprobación de la FDA, también se conformó un gran colectivo de familias que exigían vacunas para bebés e infancias pequeñas.
“No pedimos saltear ningún paso de los que las vacunas deben seguir. Confiamos en las instituciones que avalan las vacunas, pedimos la aceleración para que llegue lo antes posible en caso que cumpla con todos los requisitos en seguridad y eficacia que se piden a todas las vacunas”, planteó.
En la Argentina el proceso de aprobación es independiente de lo que determine la FDA, pero su autorización es un antecedente de importancia. “Que una vacuna tenga una autorización por otro ente regulador da mucho sustento para el análisis en cualquier otro país, aunque sea independiente. Que otros entes autoricen quiere decir que analizaron los datos y encontraron que la vacuna cumple con los requisitos que se piden. Eso aumenta la chance de que en otro país sea autorizada. Porque teóricamente se evalúa con el mismo tipo de ojo, los requisitos son los mismos que estuvimos escuchando en toda la pandemia: que sea segura y que tengan datos que sustenten que son buenas para evitar la enfermedad”, explicó Daniela, especialista en vacunas, bioquímica e investigadora principal del Conicet en el Instituto de Biotecnología y Biología Molecular de La Plata.
“Hemos visto claramente que eso de que los niños no se enferman de Covid terminó siendo un mito. Afortunadamente se enferman con menos chances de gravedad, pero no es que no ocurre. Si tenés un insumo que prevenga eso, cómo no usarlo”, remarcó. “Además, hay una población que puede tener comorbilidades y la afección puede ser más grave. Evitar esto es muy importante. Era una población que lo necesitaba”, destacó. “La noticia es muy buena y va a dar sustento para otros países como el nuestro. Argentina en eso trabaja muy bien, es pionera. Pasará por ANMAT y evaluará CoNaIn el esquema, pero ya con un sustento de una vacuna que un ente regulador dijo que está todo bien. Faltan unos pasos, pero va camino a que ocurra”, aseguró.